Задача 80213 ...
Условие
1) Fe(NO₃)₃
2) HCl
3) KClO₄
4) KNO₃
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрация веществ во всех растворах (моль/л) одинаковая.
Ответ: [ ] → [ ] → [ ] → [ ]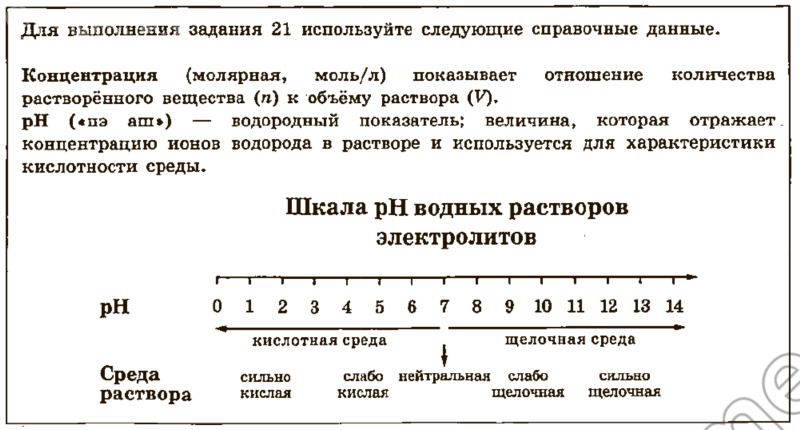
Решение
• сильный одноосновный электролит HCl → H⁺ + Cl⁻ (α ≈ 1)
• концентрация [H⁺] ≈ с.
• pH минимален (очень кислая среда).
2. Fe(NO₃)₃
• это соль сильной кислоты HNO₃ и очень слабого основания Fe(OH)₃.
• Катион Fe³⁺ активно гидролизуется:
Fe³⁺ + 3H₂O ⇄ Fe(OH)₃↓ + 3H⁺
• появляется избыток H⁺, но его меньше, чем в равномольном растворе сильной кислоты; pH > pH раствора HCl, однако среда всё-таки кислая.
3. KClO₄
• K⁺ – «сильнобазовый» катион (родитель – сильное основание KOH).
• ClO₄⁻ – «сильнокислотный» анион (родитель – сильная кислота HClO₄).
• Ни тот, ни другой ион не гидролизуются: раствор практически нейтрален → pH ≈ 7.
4. KNO₃
• K⁺ от KOH, NO₃⁻ от HNO₃ – оба иона от сильных электролитов, гидролиза нет.
• Раствор также нейтрален, pH ≈ 7 (по существу такой же, как у KClO₄).
При одинаковых молярных концентрациях:
самый низкий pH (наиболее кислая среда) …………………………… HCl
чуть выше (кислая, но слабее) ……………………………………… Fe(NO₃)₃
нейтральная среда ………………………………………………… KClO₄ ≈ KNO₃
Следовательно, в порядке возрастания pH:
2 → 1 → 3 → 4
Ответ: [2] → [1] → [3] → [4].