Задача 6341 Рассчитайте массовую долю нитрата калия...
Условие
Решение
2Pb(NO3)2––––––– > PbO+4NO2+O2(1)
2KNO3+2NO2–––– > KNO3+KNO2+H2O(2)
Количество вещества нитрата свинца (II):33,1/331=0,1моль
Тогда исходя из уравнении (2) количество вещества оксида азота (IV),будет 0,2моль. Его масса: 0,2·46=9,2г
Общая масса раствора после реакции: 500+9,2=509,2г
Количество вещества КОН в растворе: 500·0,1/56=0,89моль
Исходя из уравнении (2) видно, что КОН взята в избытке. Количество нитрата калия вычисляется по количество оксида азота (IV).Количество вещества нитрата калия, кот. образуется в результате реакции 0,1моль. Его масса: 101·0,1=10,1г .Массовая доля нитрата калия в растворе: 10,1/5009,2=0,0198 или1,98%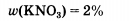
Ответ: В решение