Задача 57793 Помогите пожалуйста с 3 и 6 заданием ...
Условие
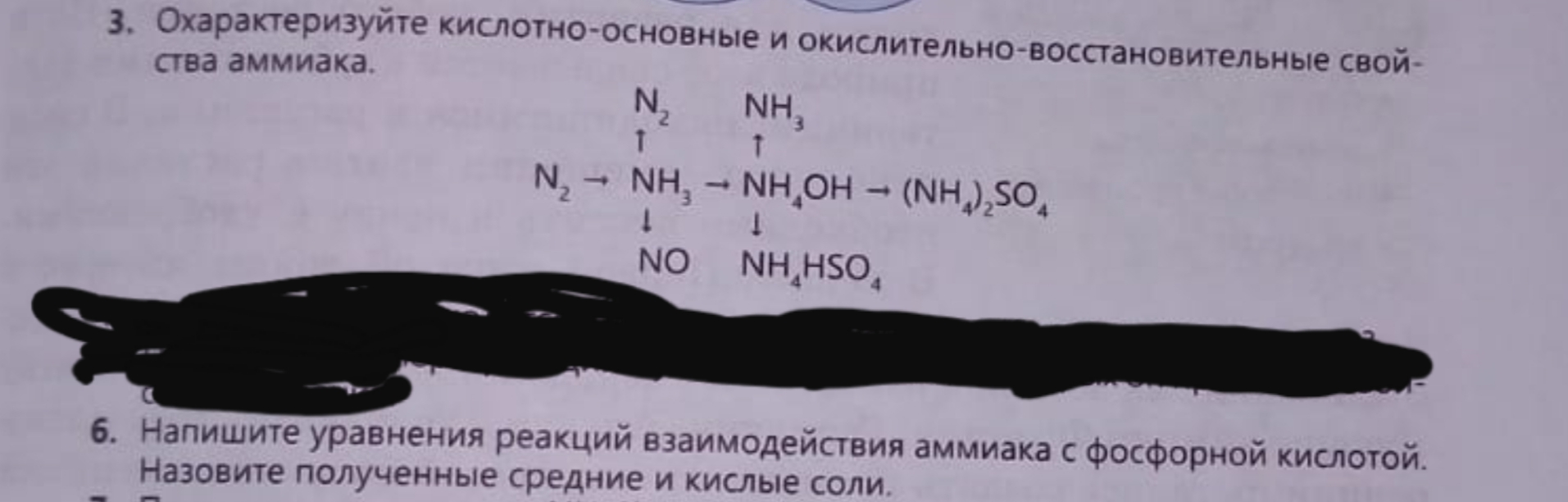
Решение
6. В данном случае происходит реакция нейтрализации.
Аммиак выступает в роли однокислотного основания, так как может присоединить один катион водорода.
Н3РО4 - трёхосновная кислота, образующая три типа солей - одну среднюю соль (ортофосфат или просто фосфат) и две кислые - гидрофосфат и дигидрофосфат.
В зависимости от соотношения NH3 : H3PO4 в растворе возможно образование
а) фосфата аммония (аммиак в избытке) :
3NH3+H3PO4=(NH4)3PO4
б) гидрофосфата аммония (соотношение 2:1)
2NH3+H3PO4=(NH4)2HPO4
в) дигидрофосфата аммония (фосфорная кислота в избытке)
NH3+H3PO4=(NH4)H2PO4
3. В кислотно-основных взаимодействиях аммиак проявляет основные свойства. Он взаимодействует с кислотами с образованием солей аммония:
NH3 + НCl = NH4Cl (хлорид аммония)
2NH3 + H2SO4 = (NH4)2SO4 (сульфат аммония)
NH3 + H2SO4 = NH4HSO4 (гидросульфат аммония)
При растворении аммиака в воде устанавливается следующая совокупность равновесных состояний:
NH3+H2O⇄NH3⋅H2O⇄NH4+ + OH− .
Поэтому водные растворы аммиака имеют щелочную реакцию
В молекуле аммиака азот находится в низшей степени окисления (–3), поэтому за счёт азота аммиак обладает только восстановительными свойствами.
При горении аммиака образуется свободный азот:
4NH3+3O2=2N2+6H2O
N восстанавливается с -3 до 0. Кислород окисляется с нуля до -2.
В присутствии катализатора (сплав Pt и Rh) NH3 окисляется кислородом с образованием NO:
4NH3+5O2=4NO+6H2O
(каталитическое окисление аммиака)
N восстанавливается с -3 до +2. Кислород окисляется с нуля до -2.