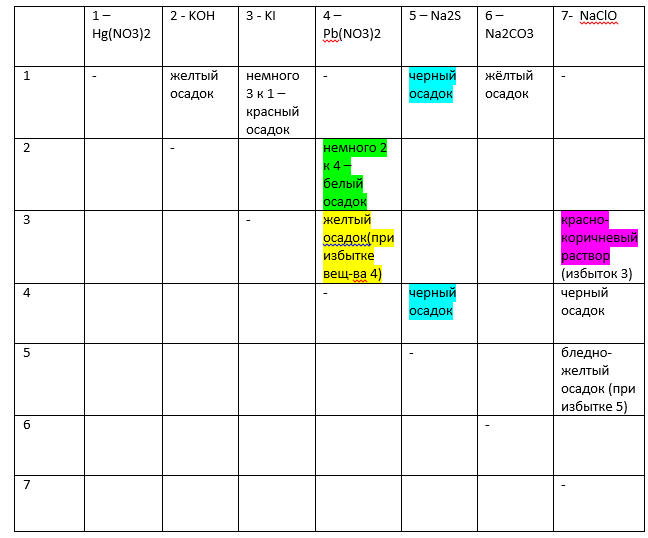
Задача 36813 В семи пробирках находятся растворы: а)...
Условие
а) KI б)Na2S в)NaClO г)Na2CO3 д)Pb(NO3)2 е)KOH д) Hg(NO3)2
— При сливании растворов 1 и 2 , 1 и 6 выпадает желтый осадок.
— При добавлении раствора 3 к раствору 1 выпадает красный осадок, а при добавлении раствора 1 к раствору 3 осадок не выпадает.
— При добавлении небольшого количества раствора 2 к раствору 4 выпадает осадок белого цвета, если же добавлять небольшое количество раствора 4 к раствору 2 осадок не выпадает.
— При добавлении небольшого количества раствора 3 к раствору 4 выпадает желтый осадок.
— При добавлении небольшого количества раствора 7 к раствору 3 получается раствор с красно-коричневой окраской, наоборот, при добавлении небольшого количества раствора 3 к раствору 7 изменения окраски не наблюдается.
— При добавлении небольшого количества раствора 7 к раствору 5 выпадает бледно-желтый осадок, а при добавлении небольшого количества раствора 5 к раствору 7 осадок не выпадает.
— При сливании растворов 5 и 1, а также 5 и 4 образуются черные осадки.
— При добавлении раствора 4 к раствору 7 выпадает черный осадок.
Установить содержимое каждой пробирки, написать уравнения реакций, протекающих при смешивании указанных растворов.
Решение
Чтобы из KI получить молекулярный йод, необходимо его окислить. Единственный сильный окислитель из перечня – NaClO.
NaClO + 2KI + H2O = I2 + NaCl + 2KOH
По уравнению реакции видим необходимость использовать йодид в избытке.
7 – NaClO
3 - KI
2) желтый осадок йодида свинца
PbI2 образует желтый осадок, однако при избыточных концентрациях KI образуется растворимый комплекс K2[PbI4].
KI + Pb(NO3) = PbI2 (осадок) + KNO3
PbI2 + 2KI = K2[PbI4]( раствор)
Уже знаем, что 3 вещество – KI. 4 –Pb(NO3)2
Какие еще соединения свинца образуются?
3) Pb(OH)2 – белый осадок, который также при избытке щелочи переходит в раствор в виде комплекса K2[Pb(OH)4].
Pb(NO3)2 + 2KOH =Pb(OH)2 + 2KNO3
2KOH + Pb(OH)2 = K2[Pb(OH)4]
Вывод: 2 – KOH
4) Сульфид дает черную окраску с некоторыми металлами.
Сульфид свинца , сульфид ртути – черные осадки.
Pb(NO3)2 + Na2S = PbS + 2NaNO3
Hg(NO3)2 + Na2S = HgS + 2NaNO3
5 – Na2S, а 1 - Hg(NO3)2
6 вещество – карбонат натрия , методом исключения.
Допишем оставшиеся реакции.
Начнем с соединений ртути:
1) Hg(NO3)2 + 2KOH = HgO + 2KNO3 + H2O
Гидроксид ртути не существует, в растворе сразу же разлагается на оксид и воду. Оксид имеет вид желтого осадка.
2) Hg(NO3)2 + KI = HgI2(красный осадок) + KNO3
HgI2 + 2KI= K2[HgI4](раствор)
3) Hg(NO3)2 + Na2CO3 = HgCO3 (желтоватый осадок) + 2NaNO3
Оставшиеся реакции с гипохлоритом натрия:
1) NaClO + Pb(NO3)2 + H2O = PbO2(черный осадок) + NaCl + 2HNO3 В ходе реакции меняется степень окисления свинца на +4. Гипохлорит снова в роли окислителя.
2) Na2S + NaClO + H2O = S + NaCl + 2NaOH
Гипохлорит окисляет сульфид до серы – желтые кристаллы.