Механизм биолюминесценции
Биолюминесценция – это процесс образования живыми организмами видимого глазом свечения в результате каталитической реакции. Самостоятельную способность к свечению имеют некоторые эукариоты – представители грибов, кишечнополостных, моллюсков, членистоногих и других групп. Однако для нас наибольший интерес представляют прокариотические светящиеся организмы. Более того, микробная биолюминесценция является на данный момент наиболее изученной областью. Несмотря на долгие годы изучения процесса, многие детали остаются не до конца изученными. В данном реферате я постаралась отразить известные и подтвержденные данные о механизмах реакции биолюминесценции.
Основные компоненты реакции биолюминесценции и их взаимодействие.
Биолюминесценция –специфическая реакция, поэтому для нее необходимы специальный фермент – люцифераза. Остальные компоненты, участвующие в реакции, являются распространенными метаболитами как прокариотических, так и эукариотических организмов. Это молекулярный кислород, флавин мононуклеотид (ФМН), длинноцепочечные альдегиды. Все специфические для светящихся микроорганизмов ферменты закодированы в lux-опероне.
Возможность протекания реакции биолюминесценции заключается в переходе избыточной энергии окисленного субстрата (люциферина и альдегида) в видимый свет, что осуществляется при возвращении возбужденного электрона на основную орбиталь (в стабильное состояние). В зависимости от того, сколько энергии выделяется при переходе электрона в основное состояние, возможен разный спектр свечения.
Фермент, который катализирует эмиссию света, называется люцифераза. Он представляет собой гетеродимер из 2-ух полипептидов (альфа и бэта–субъединицы) и кодируется генами luxA и luxB. Активный центр находится на альфа-субъединице. По сути, фермент является оксидазой (или, возможно, моноксигеназой), так как он окисляет субстрат молекулярным кислородом.
Молекула, испускающая кванты света – люциферин. Бактериальный люциферин содержит восстановленный рибофлавин-фосфат, другими словами, ФМН. В результате окисления кислородом образуется интермедиат, испускающий квант света, а затем люциферин переходит стабильную окисленную форму (оксилюциферин). Люциферин образует свечение с максимум спектра равным 495 нм. Для последующих циклов реакций оксилюциферин должен быть восстановлен с помощью донора электронов.
Флавин мононуклеотид является распространенным переносчиком электронов в ЭТЦ. Так как ФМН является участником классической дыхательной ЭТЦ, то реакция биолюминесценции – это конкурирующая за субстрат реакция, иначе говоря, шунт дыхательной цепи переноса электронов.
ФМН может отдавать/получать один электрон с преобразованием в радикал или полностью окисляться/восстанавливаться с передачей двух электронов и протонов (рис.1).
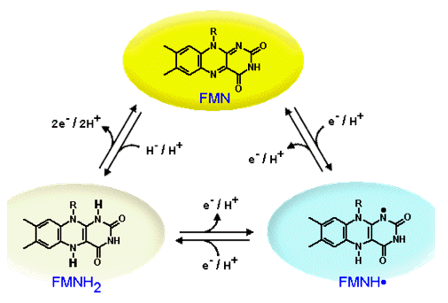
Рис.1. Переходы между окисленной, радикальной и восстановленной формами флавин мононуклеотида.
В реакции биолюминесценции восстановленный ФМН (люциферин) окисляется. Для регенерации ФМН*Н2 необходима работа еще одного фермента – ФМН-редуктазы. Редуктаза восстанавливает ФМН за счет электронов от НАДН. Согласно молекулярному анализу ФМН-редуктазы, и окисленная, и восстановленная форма ФМН прочно связываются с ферментом, поэтому отделение ФМН*Н2 является не очень вероятным процессом. В связи с этим ученые предполагают, что перенос восстановленного ФМН на люциферазу осуществляется за счет образования комплекса этих двух ферментов. В результате создания такого комплекса увеличивается эффективность реакции в целом за счет увеличения скорости переноса люциферина с люциферазы на редуктазу и наоборот.
Некоторые светящиеся бактерии имеют, помимо люциферина, вторичные эммитеры - белки, благодаря которым изменяется спектр испускаемого света. Белок люмазин (или BFP – blue fluorescent prorein) у Photobacterium phosphoreum и Photobacterium leiognathi испускает свет с максимумом около 478 нм. У штамма Vibrio fischeri Y-1 был обнаружен желтый флуоресцирующий белок, за счет которого микроорганизм светится желтым светом с максимумом 545 нм.
Универсальный акцептор электронов – молекулярный кислород. Кислород является неотъемлемой составляющей люциферазной реакции. В анаэробных условиях биолюминесценция невозможна. Кислород поставляется в клетку из окружающей среды. Кроме молекулярного кислорода в реакции могут участвовать активные формы кислорода.
В люциферазном комплексе кислород взаимодействует с люциферином и альдегидом с образованием нестабильного пероксида (пероксихемиацеталя), а тот затем быстро распадается и образуются вода, испускающий свет оксилюциферин и жирная кислота. Эти реакции представлены на рисунке 2.
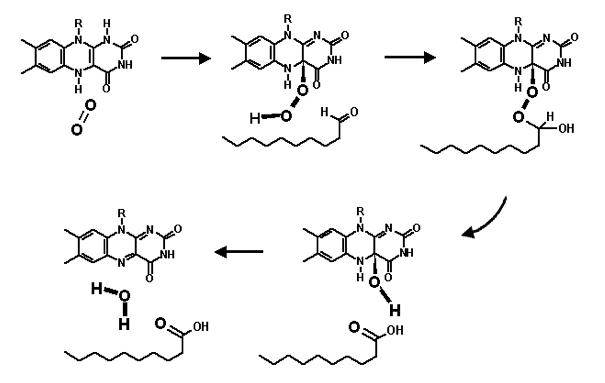
Рис.2. Механизм взаимодействия люциферина и длинноцепочечного альдегида с молекулярным кислородом в активном центре люциферазы.
Выше я уже не раз упоминала о наличии длинноцепочечных альдегидов (C8 и более) в системе в качестве косубстрата реакции. Их присутствие и роль в реакции биолюминесценции были долго неизвестны, так как альдегиды жирных кислот существуют в клетках очень непродолжительное время. Они являются токсичными для клеток, поэтому незамедлительно окисляются до жирных кислот. Кроме того, альдегиды – это крайне реакционноспособные соединения, поэтому могут спонтанно спонтанно окисляться. Длинноцепочечные альдегиды in vitro усиливают реакцию в 3-4 раза. In vivo микроорганизмы используют в реакции биолюминесценции тетрадеканаль – природный альдегид. Существует гипотеза, что длинноцепочечный алифатический альдегид способствует связыванию гидрофильного ФМН в гидрофобном активном центре фермента.
Для протекания реакции биолюминесценции необходимо постоянное наличие следовых количеств альдегидов в клетке. Регенерацию альдегидов осуществляет редуктаза жирных кислот, закодированная lux-опероне. Гены редуктазы (luxC, luxD, и luxE) в опероне следуют прямо за генами, кодирующими люциферазу. Этот белок находится в плазматической мембране, как и другие ферменты участвующие в образовании свечения. Редуктаза жирных кислот представляет собой мультиферментный комплекс и включает трансферазу (luxD), синтетазу (luxE) и собственно редуктазу (luxC). Трансфераза связывает активированные формы жирных кислот, полученных в пути биосинтеза, затем гидролизует эфир до жирной кислоты и передает ее на синтетазу. Синтетаза активирует жирную кислоту с помощью АТФ, взаимодействует с полученным ацил-АМФ и ковалентно связывает ацильный остаток. На редуктазе происходит взаимодействие тиоэфира жирной кислоты с НАД(Ф)Н и высвобождение альдегида.
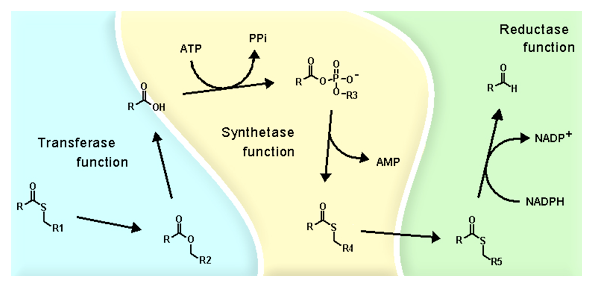
Рис.3. Схема реакций, происходящих в комплексе редуктазы жирных кислот.
Интересно, что в редуктазном комплексе ферменты расположены радиально. Вся последовательность реакций происходит от периферии комплекса, где расположены трансферазы и синтетазы, к центру, где происходит восстановление ЖК. Такое расположение ферментов позволяет эффективно перемещать гидрофобные углеводороды внутри комплекса и уменьшает их контакт с водной средой цитоплазмы.
Обобщим все выше сказанное, повторив общую последовательность реакций, которые заканчиваются образованием видимого света.
1. В клетке образуется восстановленный ФМН в результате работы ФМН-редуктазы с использованием НАДН.
2. ФМН*Н2 (вероятно в составе редуктазы) взаимодействует с люциферазой и переходит на нее, вероятно, благодаря длинноцепочечному альдегиду в активном центре.
3. К люциферазе поступает кислород и взаимодействует с ФМН*Н2 и альдегидом с образованием пероксида.
4. Пероксид нестабилен и сразу же разрушается с образованием окисленного продукта ФМН, жирной кислоты и воды.
5. Избыточная энергия от окисленного ФМН переходит в свечение. Или по туннельному механизму переходит на светоизлучающие белки, в результате чего изменяется цвет свечения.
Основные компоненты реакции биолюминесценции и их взаимодействие.
Биолюминесценция –специфическая реакция, поэтому для нее необходимы специальный фермент – люцифераза. Остальные компоненты, участвующие в реакции, являются распространенными метаболитами как прокариотических, так и эукариотических организмов. Это молекулярный кислород, флавин мононуклеотид (ФМН), длинноцепочечные альдегиды. Все специфические для светящихся микроорганизмов ферменты закодированы в lux-опероне.
Возможность протекания реакции биолюминесценции заключается в переходе избыточной энергии окисленного субстрата (люциферина и альдегида) в видимый свет, что осуществляется при возвращении возбужденного электрона на основную орбиталь (в стабильное состояние). В зависимости от того, сколько энергии выделяется при переходе электрона в основное состояние, возможен разный спектр свечения.
Фермент, который катализирует эмиссию света, называется люцифераза. Он представляет собой гетеродимер из 2-ух полипептидов (альфа и бэта–субъединицы) и кодируется генами luxA и luxB. Активный центр находится на альфа-субъединице. По сути, фермент является оксидазой (или, возможно, моноксигеназой), так как он окисляет субстрат молекулярным кислородом.
Молекула, испускающая кванты света – люциферин. Бактериальный люциферин содержит восстановленный рибофлавин-фосфат, другими словами, ФМН. В результате окисления кислородом образуется интермедиат, испускающий квант света, а затем люциферин переходит стабильную окисленную форму (оксилюциферин). Люциферин образует свечение с максимум спектра равным 495 нм. Для последующих циклов реакций оксилюциферин должен быть восстановлен с помощью донора электронов.
Флавин мононуклеотид является распространенным переносчиком электронов в ЭТЦ. Так как ФМН является участником классической дыхательной ЭТЦ, то реакция биолюминесценции – это конкурирующая за субстрат реакция, иначе говоря, шунт дыхательной цепи переноса электронов.
ФМН может отдавать/получать один электрон с преобразованием в радикал или полностью окисляться/восстанавливаться с передачей двух электронов и протонов (рис.1).

Рис.1. Переходы между окисленной, радикальной и восстановленной формами флавин мононуклеотида.
В реакции биолюминесценции восстановленный ФМН (люциферин) окисляется. Для регенерации ФМН*Н2 необходима работа еще одного фермента – ФМН-редуктазы. Редуктаза восстанавливает ФМН за счет электронов от НАДН. Согласно молекулярному анализу ФМН-редуктазы, и окисленная, и восстановленная форма ФМН прочно связываются с ферментом, поэтому отделение ФМН*Н2 является не очень вероятным процессом. В связи с этим ученые предполагают, что перенос восстановленного ФМН на люциферазу осуществляется за счет образования комплекса этих двух ферментов. В результате создания такого комплекса увеличивается эффективность реакции в целом за счет увеличения скорости переноса люциферина с люциферазы на редуктазу и наоборот.
Некоторые светящиеся бактерии имеют, помимо люциферина, вторичные эммитеры - белки, благодаря которым изменяется спектр испускаемого света. Белок люмазин (или BFP – blue fluorescent prorein) у Photobacterium phosphoreum и Photobacterium leiognathi испускает свет с максимумом около 478 нм. У штамма Vibrio fischeri Y-1 был обнаружен желтый флуоресцирующий белок, за счет которого микроорганизм светится желтым светом с максимумом 545 нм.
Универсальный акцептор электронов – молекулярный кислород. Кислород является неотъемлемой составляющей люциферазной реакции. В анаэробных условиях биолюминесценция невозможна. Кислород поставляется в клетку из окружающей среды. Кроме молекулярного кислорода в реакции могут участвовать активные формы кислорода.
В люциферазном комплексе кислород взаимодействует с люциферином и альдегидом с образованием нестабильного пероксида (пероксихемиацеталя), а тот затем быстро распадается и образуются вода, испускающий свет оксилюциферин и жирная кислота. Эти реакции представлены на рисунке 2.

Рис.2. Механизм взаимодействия люциферина и длинноцепочечного альдегида с молекулярным кислородом в активном центре люциферазы.
Выше я уже не раз упоминала о наличии длинноцепочечных альдегидов (C8 и более) в системе в качестве косубстрата реакции. Их присутствие и роль в реакции биолюминесценции были долго неизвестны, так как альдегиды жирных кислот существуют в клетках очень непродолжительное время. Они являются токсичными для клеток, поэтому незамедлительно окисляются до жирных кислот. Кроме того, альдегиды – это крайне реакционноспособные соединения, поэтому могут спонтанно спонтанно окисляться. Длинноцепочечные альдегиды in vitro усиливают реакцию в 3-4 раза. In vivo микроорганизмы используют в реакции биолюминесценции тетрадеканаль – природный альдегид. Существует гипотеза, что длинноцепочечный алифатический альдегид способствует связыванию гидрофильного ФМН в гидрофобном активном центре фермента.
Для протекания реакции биолюминесценции необходимо постоянное наличие следовых количеств альдегидов в клетке. Регенерацию альдегидов осуществляет редуктаза жирных кислот, закодированная lux-опероне. Гены редуктазы (luxC, luxD, и luxE) в опероне следуют прямо за генами, кодирующими люциферазу. Этот белок находится в плазматической мембране, как и другие ферменты участвующие в образовании свечения. Редуктаза жирных кислот представляет собой мультиферментный комплекс и включает трансферазу (luxD), синтетазу (luxE) и собственно редуктазу (luxC). Трансфераза связывает активированные формы жирных кислот, полученных в пути биосинтеза, затем гидролизует эфир до жирной кислоты и передает ее на синтетазу. Синтетаза активирует жирную кислоту с помощью АТФ, взаимодействует с полученным ацил-АМФ и ковалентно связывает ацильный остаток. На редуктазе происходит взаимодействие тиоэфира жирной кислоты с НАД(Ф)Н и высвобождение альдегида.

Рис.3. Схема реакций, происходящих в комплексе редуктазы жирных кислот.
Интересно, что в редуктазном комплексе ферменты расположены радиально. Вся последовательность реакций происходит от периферии комплекса, где расположены трансферазы и синтетазы, к центру, где происходит восстановление ЖК. Такое расположение ферментов позволяет эффективно перемещать гидрофобные углеводороды внутри комплекса и уменьшает их контакт с водной средой цитоплазмы.
Обобщим все выше сказанное, повторив общую последовательность реакций, которые заканчиваются образованием видимого света.
1. В клетке образуется восстановленный ФМН в результате работы ФМН-редуктазы с использованием НАДН.
2. ФМН*Н2 (вероятно в составе редуктазы) взаимодействует с люциферазой и переходит на нее, вероятно, благодаря длинноцепочечному альдегиду в активном центре.
3. К люциферазе поступает кислород и взаимодействует с ФМН*Н2 и альдегидом с образованием пероксида.
4. Пероксид нестабилен и сразу же разрушается с образованием окисленного продукта ФМН, жирной кислоты и воды.
5. Избыточная энергия от окисленного ФМН переходит в свечение. Или по туннельному механизму переходит на светоизлучающие белки, в результате чего изменяется цвет свечения.
Просмотры: 2151 |
Статью добавил: vk35978205 |
Категория: биология
☰ Меню