Электронное строение атома
Электроны двигаются вокруг ядра (протоны+ нейтроны) подобно планетам вокруг Солнца. Химические свойства элементов определяются расположением электронов в оболочках. Электроны имеют единичный отрицательный заряд (-1).
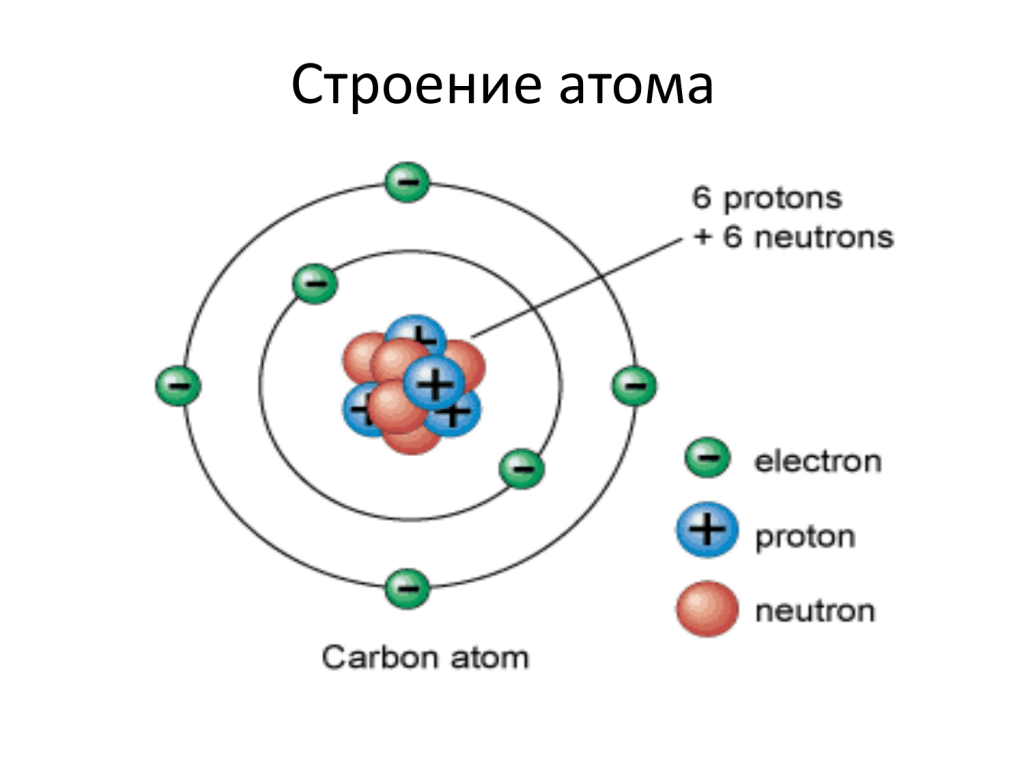
Электроны движутся вокруг ядра по строго определённым орбиталям, образуя так называемое электронное облако.
Орбиталь, по которой движется электрон – это область пространства вокруг атомного ядра, где наиболее (90 и более %) вероятно нахождение электрона.
Электроны атомов располагаются на нескольких энергетических уровнях.
Чем выше уровень, тем нестабильнее электроны на этом уровне (имеют большую энергию), поэтому именно электроны верхнего уровня участвуют в образовании новых молекул при химической реакции. Эти электроны называются валентными.
Электронный уровень соответствует периоду в периодической системе.
Водород и гелий находятся в первом периоде – у этих элементов только один электронный уровень. На данном уровне находятся только два электрона, расположенные на сферической s – орбитали. Максимальное количество электронов на 1 уровне – 2.
Элементы второго периода (литий, кислород) имеют два электронных уровня. На втором электронном уровне имеются орбитали двух типов – s- и p –орбитали. S-орбиталь всегда одна, на ней находятся два электрона с разным спином (электроны противоположны друг другу). Далее идут три p-орбитали, которые расположены в трех разных направлениях относительно ядра атома. Максимальное количество электронов на s-орбитали – 2, макс. количество электронов на всех p-орбиталях – 6. Итого, макс. количество электронов на втором энергетической уровне – 8.
Элементы третьего периода, закономерно, имеют три уровня. Первые два уровня те же, что и описаны в предыдущих двух абзацах. На третьем, кроме s- и p-орбиталей, появляются d-орбитали. Они находятся в 5 конфигурациях относительно ядра. На каждой d-орбитали , как и везде, два разнонаправленных электрона. Итого получается , что на d-подуровне (5 орбиталях) может находиться максимум 10 электронов.
Подсчитаем общее число электронов на третьем уровне: 2 на s- + 6 на p- + 10 на d- = 18 электронов.
К слову, на четвертом уровне добавляется еще один тип орбиталей (f). Подробно его рассматривать мы не будем.
Типы орбиталей:
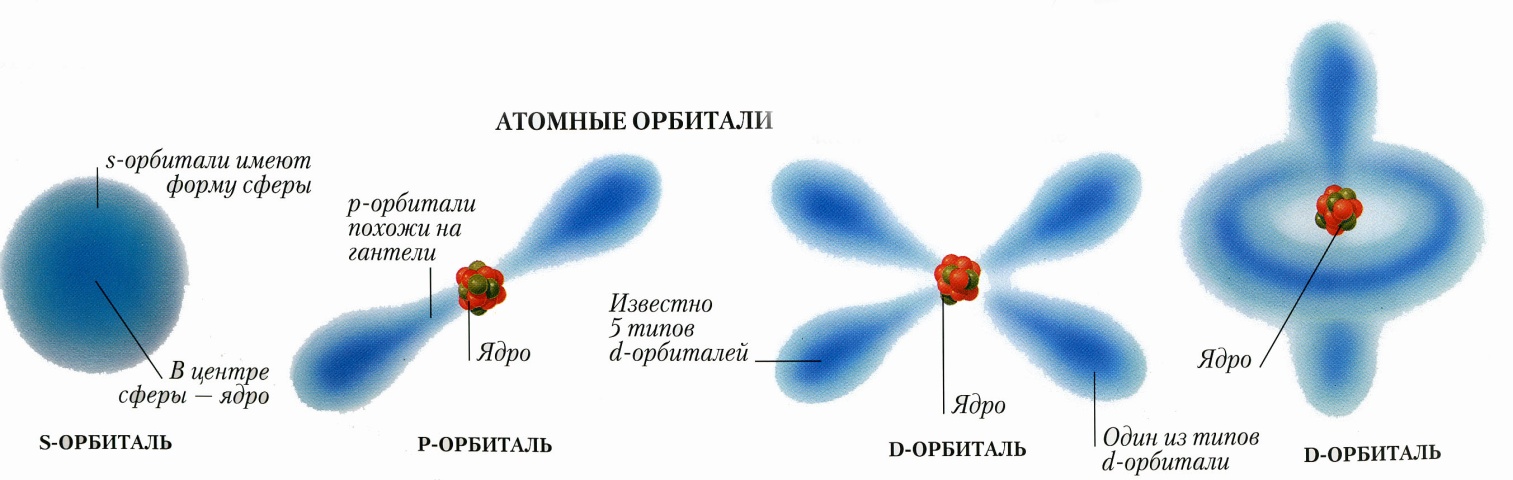
Возможные варианты орбиталей и их геометрические параметры:
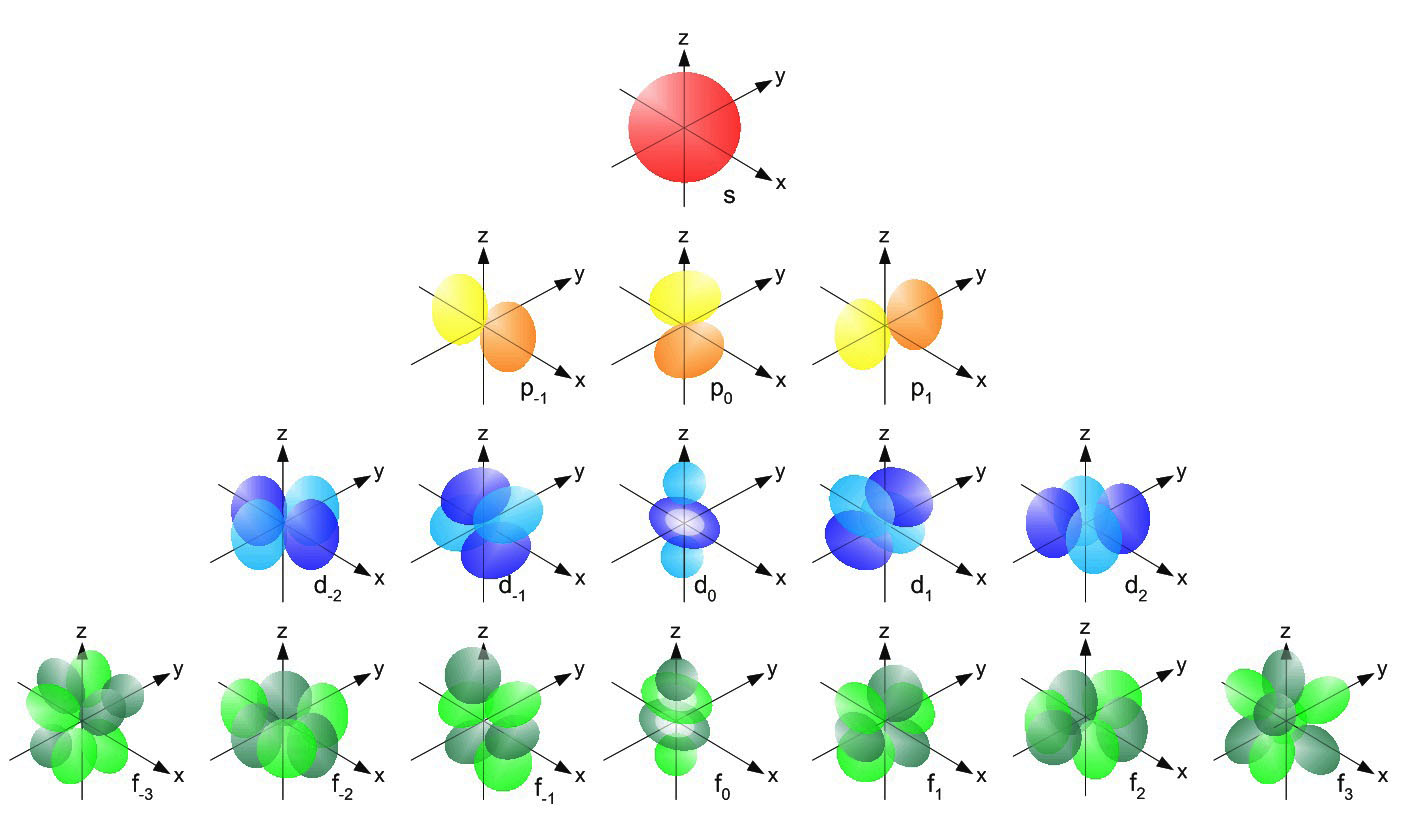
У большинства элементов верхний энергетический уровень не заполнен до конца – это энергетически невыгодное состояние, поэтому электроны на этом уровне не стабильны и побуждают атом/молекулу вступать в реакции.
Вот примеры электронного строения некоторых элементов, тут также проиллюстрированы формы отображения электронных оболочек ядра:
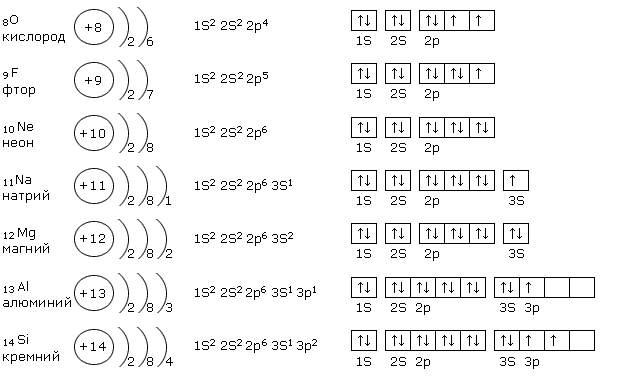
Запомним общие закономерности электронного строения атомов:
1. Атомы всегда сначала заполняют уровни, начиная с наименьшего. Чем меньше энергия уровня, тем стабильнее электрон на ней и тем ему «удобнее».
2. На одной орбитали никогда не будет двух одинаковых электронов. Электроны на орбитали имеют разное направление движения (спин).
3.

Электроны движутся вокруг ядра по строго определённым орбиталям, образуя так называемое электронное облако.
Орбиталь, по которой движется электрон – это область пространства вокруг атомного ядра, где наиболее (90 и более %) вероятно нахождение электрона.
Электроны атомов располагаются на нескольких энергетических уровнях.
Чем выше уровень, тем нестабильнее электроны на этом уровне (имеют большую энергию), поэтому именно электроны верхнего уровня участвуют в образовании новых молекул при химической реакции. Эти электроны называются валентными.
Электронный уровень соответствует периоду в периодической системе.
Водород и гелий находятся в первом периоде – у этих элементов только один электронный уровень. На данном уровне находятся только два электрона, расположенные на сферической s – орбитали. Максимальное количество электронов на 1 уровне – 2.
Элементы второго периода (литий, кислород) имеют два электронных уровня. На втором электронном уровне имеются орбитали двух типов – s- и p –орбитали. S-орбиталь всегда одна, на ней находятся два электрона с разным спином (электроны противоположны друг другу). Далее идут три p-орбитали, которые расположены в трех разных направлениях относительно ядра атома. Максимальное количество электронов на s-орбитали – 2, макс. количество электронов на всех p-орбиталях – 6. Итого, макс. количество электронов на втором энергетической уровне – 8.
Элементы третьего периода, закономерно, имеют три уровня. Первые два уровня те же, что и описаны в предыдущих двух абзацах. На третьем, кроме s- и p-орбиталей, появляются d-орбитали. Они находятся в 5 конфигурациях относительно ядра. На каждой d-орбитали , как и везде, два разнонаправленных электрона. Итого получается , что на d-подуровне (5 орбиталях) может находиться максимум 10 электронов.
Подсчитаем общее число электронов на третьем уровне: 2 на s- + 6 на p- + 10 на d- = 18 электронов.
К слову, на четвертом уровне добавляется еще один тип орбиталей (f). Подробно его рассматривать мы не будем.
Типы орбиталей:

Возможные варианты орбиталей и их геометрические параметры:

У большинства элементов верхний энергетический уровень не заполнен до конца – это энергетически невыгодное состояние, поэтому электроны на этом уровне не стабильны и побуждают атом/молекулу вступать в реакции.
Вот примеры электронного строения некоторых элементов, тут также проиллюстрированы формы отображения электронных оболочек ядра:
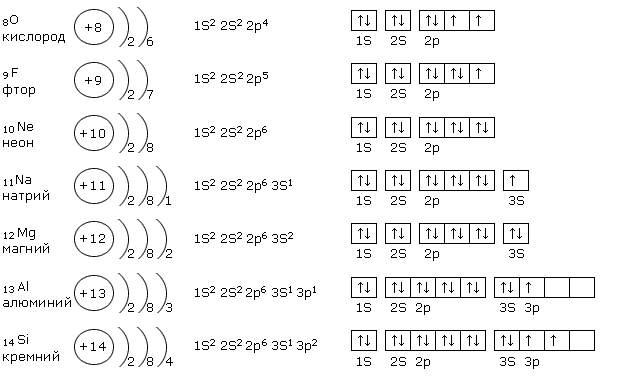
Запомним общие закономерности электронного строения атомов:
1. Атомы всегда сначала заполняют уровни, начиная с наименьшего. Чем меньше энергия уровня, тем стабильнее электрон на ней и тем ему «удобнее».
2. На одной орбитали никогда не будет двух одинаковых электронов. Электроны на орбитали имеют разное направление движения (спин).
3.

Просмотры: 8683 |
Статью добавил: vk35978205 |
Категория: химия
☰ Меню