Задача 6331 Рассчитайте массовую долю азотной...
Условие
Решение
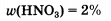
Ответ: В решение
Все решения
p=\frac{m}{V} ⇒ m=p×V
I часть
1) Найдем массу 15%-ного раствора H₂SO₄ и массу 10% раствора Ba(NO₃)₂:
m(H₂SO₄)=1,2×200=240 г
m(Ba(NO₃)₂)=1,04×150=156 г
2) Найдем массу раствора, который образовался после сливания серной кислоты и нитрата бария:
mобщего_раствора=mр-ра(H₂SO₄) +mр-ра(Ba(NO₃)₂)=240+156=396 г.
3) Найдем массы чистых (безводных веществ):
mвещества= ω%×mраствора÷100%
m(H₂SO₄)= \frac{15\%\cdot240}{100\%}=36 г
m(Ba(NO₃)₂)= \frac{10\%\cdot156}{100\%}=15,6 г
Как видно, серной кислоты в избытке, поэтому расчет будем вести по нитрату бария.
II часть
В образовавшемся растворе присутствуют осадок BaSO₄ и непрореагировавшая кислота H₂SO₄. Для того, чтобы узнать массовую долю H₂SO₄ в образовавшемся растворе, надо узнать массу осадка BaSO₄ и вычесть ее из массы нового раствора (чтоб осталась масса раствора с H₂SO₄).
1) Найдем массу образовавшегося осадка BaSO₄:
M(Ba(NO₃)₂)=261 г/моль
M(BaSO₄)=233 г/моль
m(Ba(NO₃)₂)=15,6 г
m(BaSO₄)= x г
261 г Ba(NO₃)₂ дают 233 г BaSO₄
15,6 г Ba(NO₃)₂ дают х г BaSO₄
\frac{15,6\cdot233}{261}=13,9 г BaSO₄
2) Найдем массу образовавшегося раствора без осадка:
mнов_р-ра= 396-13,9 = 382,1 г
3) Найдем массу H₂SO₄, которая прореагировала с Ba(NO₃)₂: M(Ba(NO₃)₂)=261 г/моль
M(H₂SO₄)=98 г/моль
m(Ba(NO₃)₂)=15,6 г
m(H₂SO₄)= y г
261 г Ba(NO₃)₂ прореагировало с 98 г H₂SO₄
15,6 г Ba(NO₃)₂ прореагировало с у г H₂SO₄
y=\frac{15,6\cdot98}{261}\approx5,86 г H₂SO₄
4) Найдем массу оставшейся в новом растворе серной кислоты (безводной) (см. I часть п.3)):
m(H₂SO₄)ост= 36-5,9 = 30,1 г
5) Найдем массовую долю оставшейся кислоты в новом растворе:
ω=m(H₂SO₄)/m(раствора)×100%=\frac{30,1}{382,1}\cdot100\%\approx7,9%
Ответ: массовая доля H₂SO₄ в образовавшемся растворе 7,9%.
1.1 по формуле μ=v(в-ва)/v(р-ра)
находим vв-ва(H2SO4)=0,15*200=30мл и vв-ва(Ba(NO3)2)=0,1*150=15мл
1.2 затем находим их массы по формуле: m=p*V
mв-ва(H2SO4)=1,2*30=36г
mв-ва(Ba(NO3)2)=1,04*15=15,6г
1.3 У нас теперь есть массы в-в, находим их n количество:
n=m/M, где M-молярная масса(думаю обьяснять не нужно что это)
M(H2SO4)=98г/моль
M(Ba(NO3)2)=261г/моль
n(H2SO4)=36/98=0,37моль
n(Ba(NO3)2)=0,06 моль(дальнейшие действия введутся по наименьшему кол-ву)
1.4 n(HNO3)=n(Ba(NO3)2)=1:2=0,12моль
M(HNO3)=63г/моль
mв-ва(HNO3)=63*0,12=7,56
2. Ищем mр-ра(HNO3), она складывается как: mр-ра(H2SO4)+mр-ра(Ba(NO3)2)-m(BaSO4),
2.1 Т.к по условию нам уже даны vр-ра ищем mр-ра H2SO4 и Ba(NO3)2:
mр-ра(H2SO4)=200*1,2=240г
mр-ра(Ba(NO3)2)=150*1,04=156г
2.2 Затем ищем массу BaSO4, т.к мы вели расчеты по n(Ba(NO3)2)=0,06, то соответственно n(BaSO4)=0,06 тоже
M(BaSO4)=233г/моль
m(BaSO4)=0,06*233=13,98г
3. Все данные у нас имеются осталось лишь только посчитать:
mр-ра(HNO3)=240+156-13,98=382,02
ω(HNO3)=7,56/382,02=0,02=2%
